Judith Moreno
“Excelente servicio y magnífica farmacia”
¿Tienes una cuenta?
Inicia sesión para finalizar tus compras con mayor rapidez.
$ 0.00 MXN
Envíos a todo México.
Tiempo entrega de 1 a 3 días fuera de la CDMX.
MERCK BIO
SKU:4054839325304
No se pudo cargar la disponibilidad de retiro
“Excelente servicio y magnífica farmacia”
“De excelente calidad y precio”
“El precio es el mejor del mercado”
“Al principio no llegaba mi pedido y me contacté con la farmacia, me explicaron que fue debido a problemas con la empresa de reparto y rápidamente. En menos de 1 hora recibí el pedido ya que fueron empáticos cuando les expliqué que era necesaria la toma.”
“Muy satisfecha Mexapin Ampicilina 500 mg muy buena exelente”
“Excelente todo el servicio y muy buen precio 👍”
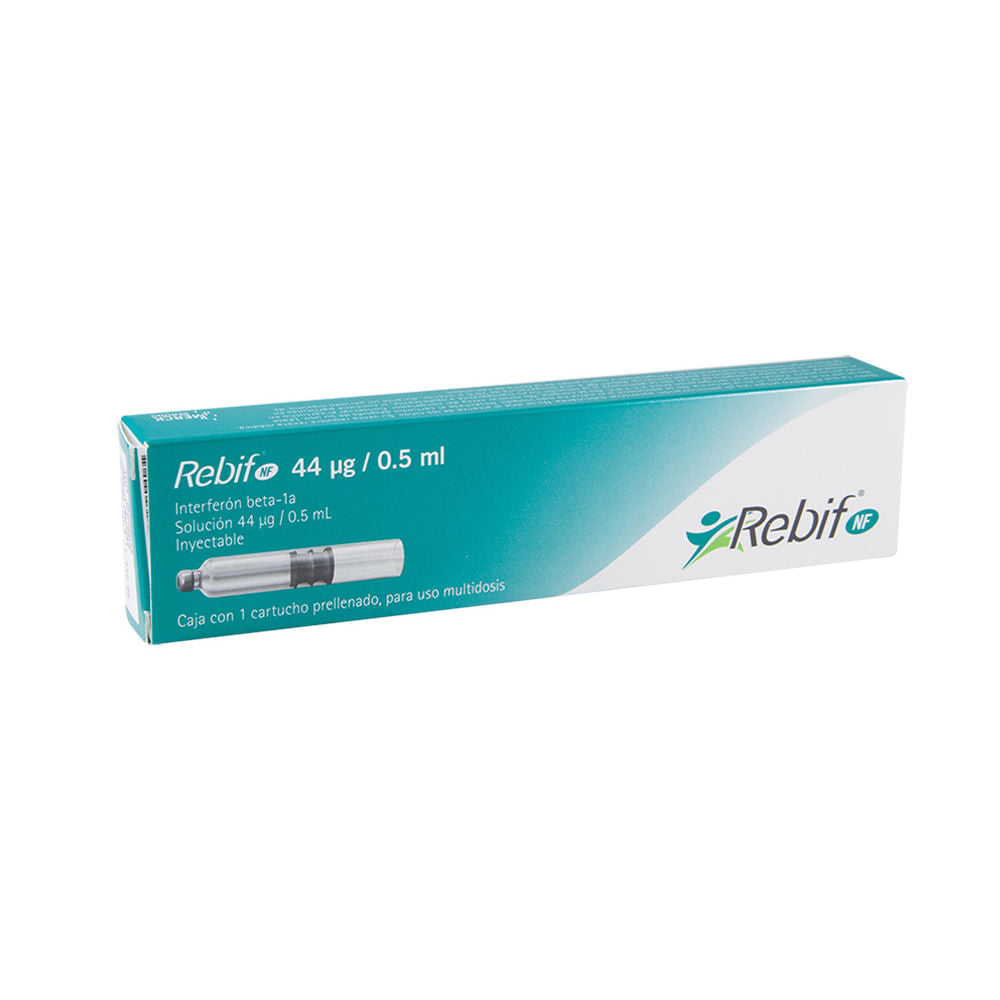
Rebif NF 44 Mg 36 Mui Prellenada 0.5 Ml
Solución inyectable libre de albúmina en cartucho prellenado. Cada cartucho prellenado contiene: REBIF® NF multidosis 44 µg: Interferón beta 1a* 132 µg Excipientes, c.b.p. 1.5 ml. * Producido por tecnología del ADN recombinante en células de ovario de hámster chino (CHO-K1).
• Inicio del tratamiento en el embarazo.
• Pacientes con historia de hipersensibilidad conocida al interferón beta natural o recombinante o a alguno de los excipientes.
• Depresión grave activa y/o ideación suicida.
Ninguna reportada.
REBIF® NF multidosis 44 y 22 µg están indicados para el tratamiento de:
• Pacientes con esclerosis múltiple remitente-recurrente (EMRR). En los ensayos clínicos, esto se caracterizó por la aparición de dos o más brotes en los dos años previos.
No se ha demostrado su eficacia en aquellos pacientes que presentan esclerosis múltiple secundaria progresiva que dejan de presentar actividad de brotes.
REBIF® NF multidosis 44 µg está indicado para el tratamiento de:
• Pacientes con un único episodio desmielinizante con proceso inflamatorio activo, si se han excluido los diagnósticos alternativos y si se determina que presentan un alto riesgo de desarrollar esclerosis múltiple clínicamente definida (véase Propiedades farmacodinámicas).
• Pacientes con esclerosis múltiple en brotes. En los ensayos clínicos, esto se caracterizó por la aparición de dos o más brotes en los dos años previos (véase Propiedades farmacodinámicas).
No se ha demostrado su eficacia en aquellos pacientes que presentan esclerosis múltiple secundaria progresiva que dejan de presentar actividad de brotes.
No se han realizado estudios de interacción farmacológica con interferón beta-1a en humanos.
Se ha notificado que los interferones disminuyen la actividad de las enzimas hepáticas dependientes del citocromo P-450, en humanos y en animales. Debe tenerse precaución cuando se administre REBIF® NF asociado a medicamentos con un estrecho índice terapéutico y cuya depuración dependa en gran manera del sistema hepático del citocromo P-450, por ejemplo, los antiepilépticos y algunas clases de antidepresivos.
No se ha estudiado sistemáticamente la interacción de REBIF® NF con los corticoides o la hormona adrenocorticotrópica o corticotropina (ACTH). Los estudios clínicos indican que los pacientes con esclerosis múltiple pueden recibir REBIF® NF y corticoides o ACTH durante los brotes.
Literatura exclusiva para médicos. No se use después de la fecha de caducidad indicada. No se deje al alcance de los niños. Su venta requiere receta médica.
No se administre si el cierre ha sido violado.
No se use en el embarazo ni en la lactancia.
Sólo deben utilizarse soluciones de transparentes
a opalescentes, sin partículas y sin signos
visibles de deterioro.
Hecho en Italia por:
Merck Serono, S.p.A.
Vía Delle Magnolie 15, (loc. Frazione Zona Industriale)
70026 Modugno, Bari, Italia
y/o
Hecho en Suiza por:
Merck Serono, S. A.
Zone lndustrielle de l'Ouriettaz, 1170
Aubonne, Suiza
Acondicionado en Uruguay por:
Ares Trading Uruguay, S. A. (A.T.U.S.A.)
Ruta 8, Km. 17.500 Zona América
Montevideo-Uruguay
Distribuido en México por:
MERCK, S. A. de C. V.
Calle 5 No. 7
Fracc. Industrial Alce Blanco, C.P. 53370
Naucalpan de Juárez, Edo. de México
Reg. Núm. 089M2010, SSA
En caso de sobredosis, se debe hospitalizar a los pacientes para observación e instaurar el tratamiento de soporte adecuado.
Existe información limitada sobre el uso de REBIF® NF en el embarazo. Los datos disponibles indican que puede haber un incremento del riesgo de aborto espontáneo. Por lo tanto, durante el embarazo está contraindicado el inicio del tratamiento con REBIF® NF.
Las mujeres en edad fértil deben utilizar medidas anticonceptivas apropiadas. Se debe informar a la paciente que se quede embarazada o que esté planificando un embarazo mientras está en tratamiento con REBIF® NF de los riesgos potenciales y debe considerarse la posibilidad de interrumpir el tratamiento. En pacientes embarazadas que presentan una alta tasa de brotes antes de iniciar el tratamiento, el riesgo de la aparición de un brote grave tras la interrupción del tratamiento con REBIF® NF debe tenerse en cuenta frente al posible riesgo de un aborto espontáneo.
Se desconoce si REBIF® NF se excreta en la leche humana, pero por la posibilidad de aparición de reacciones adversas graves en los lactantes se debe decidir si interrumpir la lactancia o el tratamiento con REBIF® NF.
Rebif NF 44 Mcg/0.5 Ml Solucion Inyectable Caja C/ 1 Cartucho Prellenado