Judith Moreno
“Excelente servicio y magnífica farmacia”
¿Tienes una cuenta?
Inicia sesión para finalizar tus compras con mayor rapidez.
$ 0.00 MXN
Envíos a todo México.
Tiempo entrega de 1 a 3 días fuera de la CDMX.
BRISTOL
SKU:7501041941855
No se pudo cargar la disponibilidad de retiro
“Excelente servicio y magnífica farmacia”
“De excelente calidad y precio”
“El precio es el mejor del mercado”
“Al principio no llegaba mi pedido y me contacté con la farmacia, me explicaron que fue debido a problemas con la empresa de reparto y rápidamente. En menos de 1 hora recibí el pedido ya que fueron empáticos cuando les expliqué que era necesaria la toma.”
“Muy satisfecha Mexapin Ampicilina 500 mg muy buena exelente”
“Excelente todo el servicio y muy buen precio 👍”
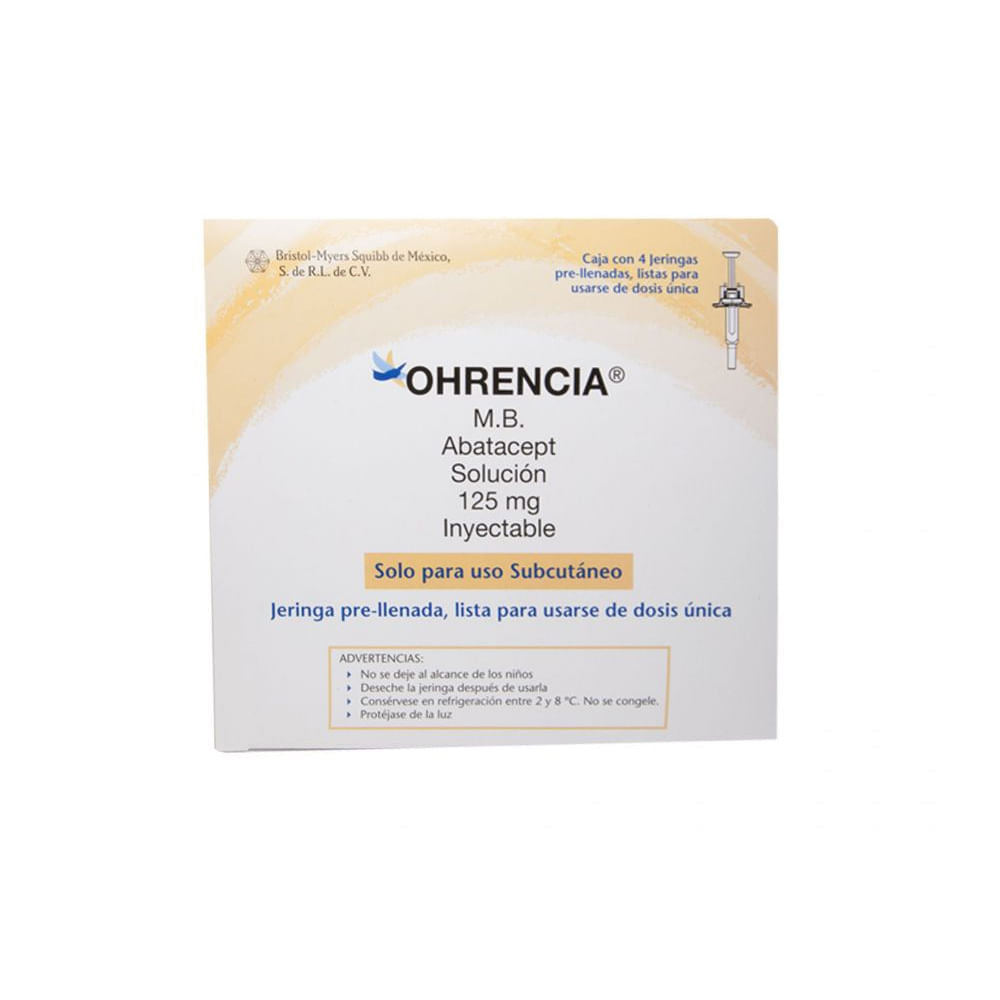
Ohrencia 125 Mg Solución Inyectable 4 Jeringas Prellenadas
Cada jeringa prellenada y Autoinyector prellenado con SOLUCIÓN contiene: Abatacept 125 mg. Excipiente cbp. Proteína de fusión de origen de ADN recombinante expresado en células de ovario de hámster chino (CHO).
OHRENCIA® no debe administrarse a pacientes con hipersensibilidad conocida a OHRENCIA® o a cualquiera de sus componentes.
Resultados de Laboratorio: Basándose en los resultados de los estudios clínicos, no es necesario pruebas especiales de laboratorio además del cuidado médico y supervisión de los pacientes.
Prueba de Glucosa en Sangre: Los fármacos parenterales que contienen maltosa pueden interferir con las lecturas de los monitores de glucosa en sangre que utilizan tiras reactivas con glucosa dehidrogenasa pirroloquinolinequinona (GDH-PQQ). La GDH-PQQ basada en sistemas de monitoreo de glucosa puede reaccionar con la maltosa presente en OHRENCIA®, causando lecturas de glucosa en sangre falsamente elevadas durante el día de infusión. Los pacientes que requieren el monitoreo de glucosa en sangre deben ser aconsejados de considerar métodos que no reaccionen con la maltosa, como aquellos basados en la glucosa dehidrogenasa nicotina adenina dinucleótida (GDH-NAD), glucosa oxidasa o métodos de prueba de glucosa hexocinasa (ver Precauciones generales: Pruebas de glucosa en sangre).
Artritis Reumatoide (AR) en adultos: OHRENCIA® puede ser administrado como infusión intravenosa (IV) o por inyección subcutánea (SC) para Artritis Reumatoide (AR) en Adultos.
OHRENCIA® está indicado para reducir signos y síntomas, inducir una respuesta clínica mayor, inhibir la progresión de daño estructural, y mejorar la función física en pacientes adultos con artritis reumatoide activa de moderada a grave. OHRENCIA® puede ser usada como monoterapia o en combinación con otros fármacos antirreumáticos modificadores de la enfermedad (FARME por sus siglas en español o DMARD, por sus siglas en inglés) diferentes a agentes antagonistas de factor de necrosis tumoral (TNF).
Artritis Juvenil Idiopática: OHRENCIA® debe ser administrado como infusión intravenosa (IV) para Artritis idiopática juvenil.
OHRENCIA® IV está indicado para reducir signos y síntomas en pacientes pediátricos de 6 años y mayores con artritis idiopática juvenil poliarticular con actividad de moderada a grave. OHRENCIA® puede ser usado como monoterapia o en combinación con metotrexato (MTX).
Limitaciones importantes para su uso: OHRENCIA® no debería ser usado en combinación con antagonistas del Factor de Necrosis Tumoral (TNF, por sus siglas en inglés) (Ver Precauciones generales: Combinación con agentes Antagonistas del TNF). OHRENCIA® no está recomendado para usarse en combinación con otros medicamentos biológicos para la artritis reumatoide como anakinra (Ver Interacciones medicamentosas y de otro género).
Literatura exclusiva para médicos. Su venta requiere receta médica. Si no se administra todo el producto deséchese el sobrante. No se administre si la solución no es transparente, si contiene partículas en suspensión o sedimentos. El uso de este medicamento durante el embarazo queda bajo la responsabilidad del médico. No se use durante la lactancia. No se deje al alcance de los niños.
Reporte las sospechas de reacción adversa al correo:
farmacovigilancia@cofepris.gob.mx
safety_mexico@bms.com
Titular del registro:
Bristol-Myers Squibb Holdings Pharma, Ltd. Liability Company
Tierras Nuevas Route 686, Km. 2.3
Manati, Puerto Rico, 00674, EUA
Representante legal:
BRISTOL-MYERS SQUIBB DE MÉXICO, S. de R. L. de C. V.
Avenida Insurgentes Sur No. 1602, Piso 5,
Col. Crédito Constructor, C.P. 03940,
Benito Juárez, Ciudad de México, México.
Registro sanitario del medicamento: 197M2009, SSA IV
Registro sanitario del dispositivo médico: 1048C95, SSA
CCDS: 19 Noviembre 2014.
Fecha de Aprobación: 15 Noviembre 2016.
Se han administrado dosis de hasta 50 mg/kg por vía intravenosa sin efecto tóxico aparente. En caso de sobredosificación, se recomienda que el paciente sea monitoreado para determinar la presencia de signos o síntomas de reacciones adversas y para poder iniciar un tratamiento sintomático apropiado.
No existen estudios en mujeres embarazadas. OHRENCIA® puede utilizarse en embarazo solamente si es estrictamente necesario.
El abatacept puede atravesar la placenta hacia suero de los recién nacidos de mujeres tratadas con abatacept durante el embarazo. En consecuencia, estos recién nacidos pueden estar en mayor riesgo de infección. La seguridad de la administración de vacunas vivas en los bebés expuestos a abatacept en el útero es desconocida. La administración de vacunas vivas a los bebés expuestos a abatacept en el útero no se recomienda durante 10 semanas después de la última exposición de la madre a abatacept durante el embarazo.
Se ha mostrado que abatacept está presente en leche de rata. Se desconoce si abatacept es excretado en leche humana. A las madres se les debe dar instrucciones de no amamantar si están recibiendo OHRENCIA®.
Ohrencia 125 Mg Solucion Inyectable C/ 4 Jeringa Prellenada