Judith Moreno
“Excelente servicio y magnífica farmacia”
¿Tienes una cuenta?
Inicia sesión para finalizar tus compras con mayor rapidez.
$ 0.00 MXN
Envíos a todo México.
Tiempo entrega de 1 a 3 días fuera de la CDMX.
SANDOZSACV
SKU:7502216932517
No se pudo cargar la disponibilidad de retiro
“Excelente servicio y magnífica farmacia”
“De excelente calidad y precio”
“El precio es el mejor del mercado”
“Al principio no llegaba mi pedido y me contacté con la farmacia, me explicaron que fue debido a problemas con la empresa de reparto y rápidamente. En menos de 1 hora recibí el pedido ya que fueron empáticos cuando les expliqué que era necesaria la toma.”
“Muy satisfecha Mexapin Ampicilina 500 mg muy buena exelente”
“Excelente todo el servicio y muy buen precio 👍”
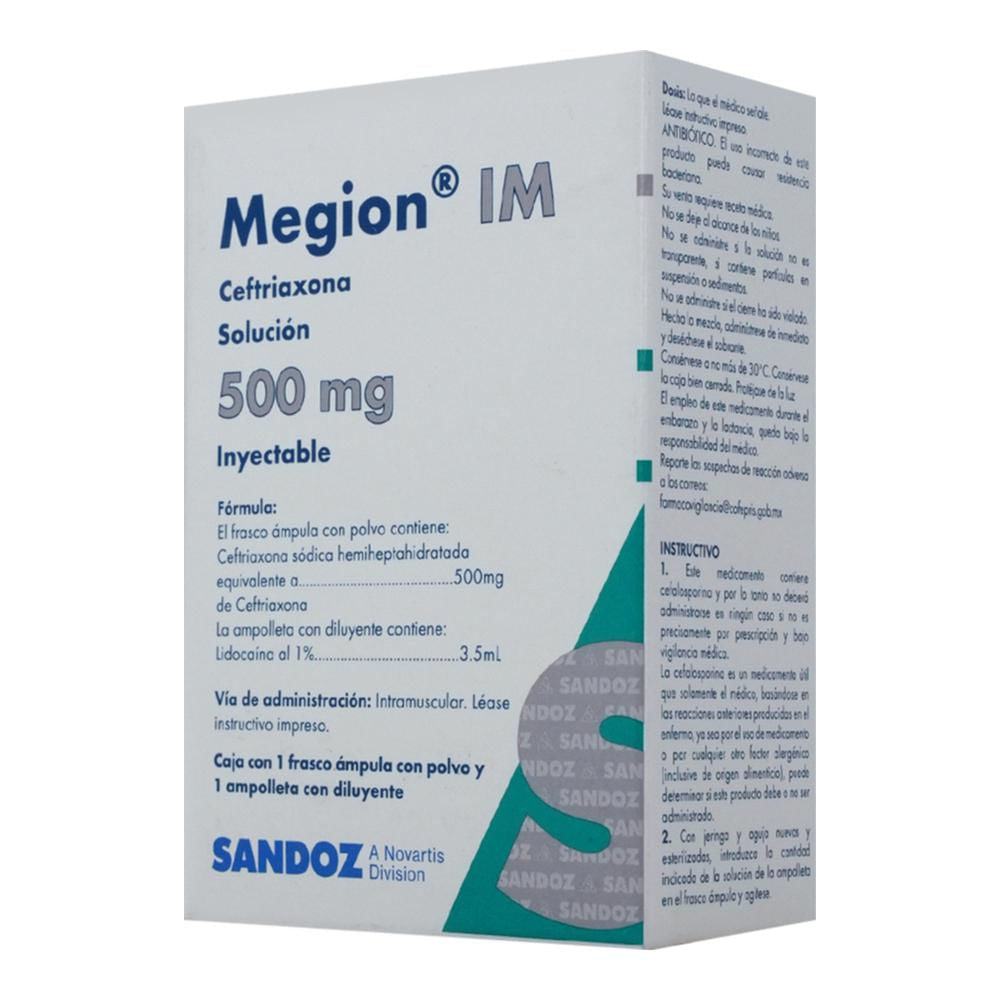
Megion I.M. 500 Mg 2 Ml Frasco Ámpula
El frasco con polvo contiene: Ceftriaxona sódica hemiheptahidratada equivalente 500 mg de Ceftriaxona
La ampolleta con diluyente contiene: Lidocaína al 1% 3.5 mL
En pacientes tratados con ceftriaxona, en raros casos la prueba de Coombs puede dar falsos positivos.
La ceftriaxona, como otros antibióticos, puede dar falsos positivos en pruebas de galactosemia.
De igual forma, los métodos no enzimáticos para la determinación de glucosa en orina pueden dar resultados falsos positivos.
Por esta razón, la determinación de los niveles de glucosa en orina durante la terapia con ceftriaxona debe realizarse con métodos enzimáticos.
Su venta requiere receta médica. No se deje al alcance de los niños. Literatura exclusiva para médicos. No se administre si la solución no es transparente, si contiene partículas en suspensión o sedimentos. No se administre si el cierre ha sido violado. Dilúyase con lidocaína al 1% al volumen indicado. Hecha la mezcla, adminístrese de inmediato y deséchese el sobrante. En caso de embarazo o lactancia, consulte a su médico. ANTIBIÓTICO. El uso incorrecto de este producto puede causar resistencia bacteriana.
Reporte las sospechas de reacción adversa al correo: farmacovigilancia@cofepris.gob.mx
Propiedad de:
Sandoz GmbH
Biochemiestraße 10, 6250 Kundl
Austria
Representante Legal:
SANDOZ, S.A. de C.V.
La Candelaria No. 186, Col. Atlántida
C.P. 04370, Coyoacán, Ciudad de México, México
Reg. Núm. 141M2002, SSA IV/347M2016, SSA (diluyente)
193300001T0126/28sep2020/IPPA_DRA-Sandoz
®Marca Registrada
En caso de una sobredosis pueden ocurrir náusea, vómito, diarrea. La concentración de ceftriaxona no se puede reducir por hemodiálisis o diálisis peritoneal. No hay un antídoto específico. El tratamiento es sintomático.
Embarazo: La ceftriaxona atraviesa la barrera placentaria. Existen cantidades limitadas de datos sobre el uso de ceftriaxona en mujeres embarazadas. Estudios en animales no indican efectos dañinos directos o indirectos con respecto al desarrollo embrional/fetal, perinatal y postnatal (véase la sección Precauciones en relación con efectos de carcinogénesis, mutagénesis, teratogénesis y sobre la fertilidad). Ceftriaxona sólo debería ser administrada durante el embarazo y en particular en el primer trimestre de embarazo si el beneficio es mayor que el riesgo.
Lactancia: Ceftriaxona es excretada a través de la leche humana en bajas concentraciones, pero en dosis terapéuticas no se prevé ningún efecto en los lactantes. Sin embargo, el riesgo de diarrea y micosis de las membranas mucosas no puede ser excluido. La posibilidad de sensibilización debería ser tomada en cuenta. Se debe tomar una decisión si descontinuar la lactancia o abstenerse/interrumpir la terapia con ceftriaxona, tomando en cuenta el beneficio de la lactancia para el niño y el beneficio de la terapia para la mujer.
Fertilidad: Estudios reproductivos no han mostrado evidencia de efectos adversos en la fertilidad de pacientes del género masculino o femenino.
Megion Solucion Inyectable 500 Mg 2 Ml C/1 Ampolletas (A)